Resumen— Nuestros huesos pueden sufrir varios tipos de enfermedades tales como cáncer, osteoporosis o infecciones y hay que buscar soluciones para combatirlas. En este artículo vamos a explicar algunas ideas para encontrar soluciones a estos problemas tales como la nanopartícula de sílice mesoporosa que puede tratarse químicamente para introducirle medicamentos. Utilizando estímulos como radiación ultravioleta, ultrasonidos, calor o señales magnéticas se puede conseguir que suelten su carga en el sitio preciso y en el momento adecuado.
Palabras clave — nanomedicina, nanopartículas mesoporosas de sílice, cáncer, osteoporosis
Indice de contenidos
INTRODUCCIÓN
En este artículo vamos a comentar una vía de futuro de cómo sería posible combatir a las enfermedades del hueso utilizando nanopartículas mesoporosas de sílice.
Diseñar nanopartículas de sílice que puedan combatir enfermedades tales como cáncer, infección y osteoporosis de los huesos podría ser una magnifica solución y brindar la oportunidad de desarrollar terapias personalizadas a través de la liberación de fármacos de forma controlada que lleguen solo al lugar donde son necesarios. Esto permitiría utilizar dosis infinitamente más pequeñas lo que puede resolver gran parte de los problemas que originan las grandes dosis de medicamentos que actualmente se utilizan (Fig. 1).
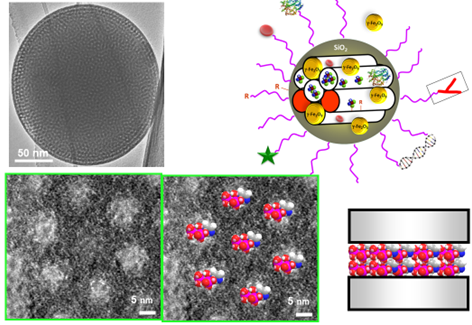
Fig. 1 Nanopartícula de sílice mesoporosa a distintos aumentos. Vista de fármacos ocupando sus poros. Esquema de la nanopartícula visualizando la ocupación de los poros por distintas especies y su superficie preparada para distintas funciones. Chem.Soc.Rev.,2022,51, 5365
NANOMEDICINA
Pero para entender todo esto tenemos que remontarnos a la NANOMEDICINA y el tamaño de lo que manipulamos.
En un momento de la historia en que la sociedad parecía necesitar lo “grande” (coches más grandes, casas más grandes, televisores más grandes, etc.) Richard Feynman hizo retroceder la marea y se centró en lo “pequeño”. Una nueva perspectiva que nos permitió redescubrir materiales cotidianos con nuevas propiedades y aplicaciones. Un ejemplo representativo se puede encontrar en la evolución de los materiales de carbono. En el pasado, solo se conocían diamantes, de gran dureza, y grafito, fácilmente laminable y elemento clave de los lápices. Durante los años 50 del siglo XX, la fibra de carbono (formada por filamentos de unas pocas micras) surgió como un material ligero y extremadamente resistente que ganó importancia en la industria aeronáutica, la del transporte y los deportes de alta competición. Posteriormente, el descubrimiento de los nanotubos de carbono y del grafeno, cuyas propiedades térmicas y eléctricas aumentan considerablemente e incluso superan a las de los metales conductores, revolucionaron el campo de los materiales de carbono. El silicio, situado en el mismo grupo que el carbono en la tabla periódica y de gran abundancia en la corteza terrestre, ha permitido fabricar materiales cuya miniaturización ha propiciado la aparición de nuevas propiedades con aplicación en numerosos campos como la medicina, materiales estructurales, campo agrícola a la biorremediación ambiental, células solares, etc.
NANOMATERIALES BASADOS EN SÍLICE
Dependiendo de las condiciones y técnicas utilizadas durante su síntesis, es posible obtener dos tipos diferentes de nanomateriales basados en silicio:
1 nanomateriales cuya composición es idéntica a la del silicio original (Si-Si),
2 y nanomateriales de sílice, óxido de silicio (sílice, SiO2)
Sin duda, en la medicina el uso de nanomateriales a base de silicio se ha generalizado.
Dos de las principales razones son, que los nanomateriales de silicio y sílice tienen una gran resistencia mecánica y estabilidad térmica, y que son sustratos ideales para la funcionalización en función de cual haya sido el método de síntesis empleado para su fabricación.
Esto supone una gran ventaja ya que se trata precisamente de la posibilidad de anclar una gran variedad de elementos en la superficie de los nanomateriales, lo que permite modificar sus propiedades en función del tratamiento necesario (Fig. 2).
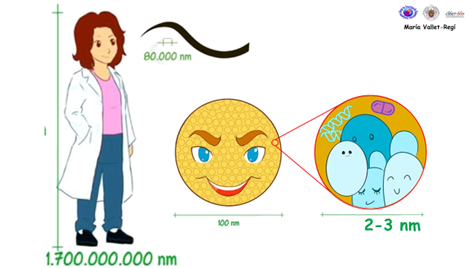
Fig. 2 Tamaño de las nanopartículas y sus poros. Eso nos permite compararlo con el espesor de un pelo o el tamaño de un adulto para darnos cuenta de lo pequeñísimos que son
NANOMATERIALES BASADOS EN SILICE: SUS CARACTERÍSTICAS
Se puede preparar tanto el interior como el exterior de las nanopartículas de sílice para adecuarlas a donde tienen que llegar y lo que tienen que depositar al llegar a destino.
Tenemos que sintetizarlas en el laboratorio con muchísimos poros en los que cargar los fármacos, a continuación, evitar que se aglomeren, prepararlos con las especies óptimas para que llegue a su destino, impedir que los fármacos se escapen antes de llegar a su destino y, por último, conseguir que se liberen al alcanzarlo. Se ha demostrado que los nanomateriales basados en silicio no son tóxicos para los sistemas biológicos cuando se preparan con las características estructurales apropiadas y se aplican en las dosis correctas. Se han realizado numerosos estudios para investigar cómo el tamaño, la forma y otros factores estructurales afectan a sus actividades biológicas, tales como: endocitosis a través de las membranas celulares, interferencias dentro de la señalización celular, interacción con orgánulos celulares, etc.
En cuanto a su eliminación, la biodegradación de nanomateriales basados en silicio in vivo ocurre principalmente por disolución en fluidos biológicos. Su degradación tiene lugar en forma de ácido silícico, un compuesto naturalmente presente en los seres humanos en pequeñas concentraciones. Se ha comprobado que dicha degradación tiene lugar más rápido en las nanopartículas de silicio que en las de óxido de silicio, y en ambos casos, la porosidad acelera el proceso mientras que la funcionalización puede ralentizarlo en función de cuál sea. La eliminación de materiales basados en silicio se produce por vía renal y hepática en forma de orina y heces que contienen nanopartículas sólidas o productos degradados, siendo la excreción renal la principal vía.
Aunque la estructura en sí no es tóxica, si no se eliminan adecuadamente, los tensioactivos residuales (que a menudo son catiónicos) y los disolventes orgánicos (utilizados durante el proceso de síntesis) pueden ser perjudiciales para las membranas celulares debido a su naturaleza lipofílica o la generación de radicales libres.
Tanto los nanomateriales de silicio como los de sílice se pueden sintetizar con numerosos poros por los que introducir los medicamentos. Los fármacos, incluidos los poco solubles en agua, pueden cargarse en los poros y protegerse del entorno biológico hasta que la partícula llegue a su destino.
El tamaño de las nanopartículas de sílice está en torno a los 100 nanómetros y el tamaño del diámetro de sus poros en torno a 2. Dado que las moléculas de antibióticos miden en torno a 1 nanómetro la capacidad de carga es enorme. Cada nanopartícula tiene unos 1400 poros de unos 100 nanómetros de longitud así que pueden transportar las dosis necesarias de antibióticos para curar la infección porque solo depositaran su carga en el lugar de la infección sin diseminarla por el resto del cuerpo. Y seleccionando bien los medicamentos apropiados para curar cáncer, infecciones u osteoporosis podremos encontrar nuevas opciones para resolver estas enfermedades.
NANOPARTÍCULAS PARA CURAR INFECCIONES
Las infecciones están emergiendo cada vez más como una causa de morbilidad y mortalidad en todo el mundo, debido a la rápida aparición y diseminación de patógenos resistentes a los medicamentos que han adquirido nuevos mecanismos de resistencia. Las bacterias, virus, hongos y parásitos cambian con el tiempo cuando se exponen a medicamentos antimicrobianos, como antibióticos, antivirales, antifúngicos y antihelmínticos, respectivamente. En consecuencia, los medicamentos se vuelven ineficaces y las infecciones persisten en el cuerpo, aumentando el riesgo de propagación. El problema cada vez más acuciante del consumo excesivo de antibióticos hará que en pocos años hayan perdido su eficacia, por lo que se multiplicarán las muertes por infección. Por tanto, hay que buscar soluciones que deben ser eficaces ya que interesa que actúen sólo donde son necesarios y a su vez conseguir que entren en el cuerpo humano dosis infinitamente pequeñas (Fig. 3).

Fig. 3 Secuencia en la preparación de nanopartículas de sílice: Síntesis, unión de un dispersante, unión de elementos de señalización, unión de compuertas moleculares para impedir la salida de los fármacos antes de llegar a su destino y por último aplicación de un estímulo para abrir las compuertas cuando tengan que salir los fármacos. Los ensayos se hacen primero in vitro en el laboratorio y posteriormente in vivo en animales y humanos. Acta Biomater., 2022, 137, 44–52
Según la OMS, la resistencia a los antibióticos es una preocupación importante que amenaza la salud mundial. Actualmente, las enfermedades resistentes a los medicamentos causan al menos 700 000 muertes cada año, y esta cifra podría aumentar a 10 millones en el año 2050. De hecho, se prevé que, para esta fecha, habrá más muertes por infección que por cáncer. Estas afirmaciones son las oficiales, pero las predicciones actuales apuntan que tal vez son precipitadas, exageradas y politizadas. En cualquier caso, hay que ir buscando soluciones de la mano de la CIENCIA.
Las infecciones relacionadas con los aparatos ortopédicos, con más de un millón y medio de reemplazos totales de cadera y rodilla que se realizan cada año, constituyen un grave problema. La superficie del implante es un ambiente ideal para la adhesión y colonización bacteriana. Y si añadimos que el desgaste inducido por micro-movimientos de estas prótesis ortopédicas causa la liberación de desechos que desencadenan la inflamación local, se genera un nicho ideal para la infección.
Cuando se diagnostica una infección en una prótesis, uno de los retos es su completa eliminación de la zona infectada incluyendo el implante y la zona necrótica circundante, pero el éxito depende de la completa eliminación del tejido infectado y de la infección sobre la superficie del implante, que lamentablemente es muy difícil de conseguir ya que las bacterias latentes no se eliminan por completo.
La naturaleza recurrente y resistente de las infecciones óseas, así como la alta morbilidad asociada, han llevado a la comunidad científica a dedicar muchos esfuerzos para desarrollar nuevas terapias destinadas a mejorar los estándares de los que se dispone hoy en día
Como estrategias para evitar la infección ósea se han desarrollado, entre otras, superficies que impidan la adhesión bacteriana sobre los implantes y evitar la formación de biofilms.
Específicamente en el tratamiento de infecciones bacterianas, los nanomateriales basados en silicio han demostrado ser altamente efectivos en varios niveles, incluida la detección temprana, la orientación hacia bacterias o biofilms y la prevención en la formación de biofilms.
Su uso como sistema de administración de fármacos permite aumentar la efectividad del antibiótico y la reducción de la dosis, ayudando a resolver el problema de la resistencia a los antibióticos. Su utilización generalizada sería una gran alternativa a la síntesis de nuevos antibióticos cuyo proceso requiere una alta inversión de tiempo y dinero. Podríamos alargar muchísimo la vida de los que ya tenemos ya que al utilizar dosis mínimas el problema se diluye.
Otros transportadores de antibióticos pueden ser bacterias y células.
La mayoría de las bacterias viven aglomeradas en auténticas comunas, se comunican entre sí e intercambian genes entre ellas con mucha facilidad.
Cuando hay una infección tanto de un implante como de cualquier tejido, las bacterias se organizan formando lo que se conoce como biofilm que es un conglomerado de bacterias, y otros microorganismos, atrapados en una matriz de polisacáridos y proteínas.
El biofilm es una auténtica barrera que impide que los antibióticos puedan penetrar a la zona infectada de la misma forma que un chubasquero impide que traspase el agua. En efecto, las bacterias forman micro colonias de millones de individuos en el interior de nuestro cuerpo por ejemplo en el intestino, en la piel o en la boca. La vida en comunidad les aporta un sistema de autodefensa y así las bacterias del biofilm son más resistentes a las agresiones externas, sobreviven mejor y se facilita su propagación.
Para hacernos una idea de la proporción de bacterias que constituyen nuestro cuerpo basta con hacer un cálculo y comprobar que en un adulto hay entre 2 o 3 kilos de bacterias. Sabemos que por cada célula humana tenemos en nuestro cuerpo al menos una bacteria y que hay más de 10.000 tipos distintos de especies bacterianas.
En nuestro organismo hay miles de millones de microorganismos (bacterias, virus, hongos, levaduras y otros) que viven en nuestro interior y en nuestra piel. Es lo que se denomina microbiota.
Y toda esta riqueza y variedad de bacterias nos permite diseñar nuevos transportadores de fármacos.
NANOPARTÍCULAS TRANPORTADAS POR BACTERIAS
Veamos como las bacterias pueden transportar nanopartículas cargadas con fármacos hacia tejidos infectados. Junto a las nanopartículas de sílice constituyen parte de un auténtico parque móvil de medicamentos.
Determinadas cepas bacterianas son capaces de colonizar de forma muy eficaz tejidos infectados guiadas por su preferencia a habitar en zonas que poseen ciertas condiciones particulares, tales como entornos hipóxicos (con bajo nivel de oxígeno) o por la presencia de gradientes de determinadas biomoléculas.
Ante esta situación es posible desarrollar una metodología para anclar nanopartículas en la superficie de bacterias capaces de penetrar en tejidos infectados aumentando el efecto de las medicinas.
Se pueden anclar nanopartículas cargadas con fármacos en la superficie de bacterias con el fin de transportarlos a zonas de difícil acceso
Las nanopartículas, al ser relativamente grandes (unos 100 nanómetros) en comparación con las moléculas que transportan (en torno a 1 nanómetro) no son capaces de penetrar profundamente en los tejidos infectados ya que su velocidad de difusión es muy lenta. Además, la alta presión intersticial presente en esos tejidos hace todavía más difícil la penetración de las nanopartículas hacia regiones internas.
Este hecho acarrea que el efecto de estas medicinas quede limitado en muchas ocasiones únicamente a la periferia del tejido infectado, y, por tanto, la eficacia del tratamiento se vea reducida considerablemente.
Esto se puede resolver aprovechando la habilidad de las bacterias para mejorar significativamente la penetración de medicinas en un tejido infectado utilizando a estos microorganismos como portadores activos.
Para ello se utiliza una estrategia química mediante la cual consiguen anclar nanopartículas a la pared celular de las bacterias, utilizando E. coli como cepa modelo puesto que al ser bacterias que poseen flagelos, tienen una alta capacidad de movilidad.
Este método consiste en alimentar a las bacterias con un medio enriquecido en un aminoácido sintético (Azida-D-alanina) que contiene un grupo azida en su cadena lateral. Las bacterias no distinguen este aminoácido sintético de la D-alanina no modificada y la incorporan a la construcción de su pared celular quedando así “marcada” con grupos azida.
Cuando estas bacterias se ponen en contacto con nanopartículas cargadas con fármacos y cuya superficie se decoró previamente con moléculas de un compuesto específico conocido como DBCO, se produce una reacción química de tipo “click” prácticamente inmediata entre la azida y el DBCO que liga fuertemente a los nanotransportadores a la superficie de la bacteria sin afectar a ninguna de sus funciones vitales.
De esta forma, consiguen que las bacterias sean capaces de transportar nanopartículas de sílice mesoporosa cargadas con un potente fármaco hasta zonas profundas del tejido infectado
La seguridad de esta estrategia se podría asegurar empleando bacterias modificadas genéticamente para no tener patogenicidad o bacterias beneficiosas para el organismo.
Y el parque móvil se completa con las células, que pueden transportar nanopartículas cargadas con fármacos hacia tejidos infectados
En los sistemas de nanopartículas mesoporosas de sílice se busca como dirigir las nanopartículas cargadas y proteger su carga hasta el final de su camino, su destino. Y qué mejor que buscarles un transporte. En efecto, es conocido que las células mesenquimales en los casos de cáncer de mama se dirigen hacia el tejido tumoral en un intento de aportar soluciones. Ante esta realidad se abre la posibilidad de utilizar células como transporte para nanopartículas cargadas. Se pueden diseñar plataformas constituidas por nanopartículas mesoporosas de sílice que son transportadas, por ejemplo, por células madre mesenquimales. Esta solución se ha comprobado que funciona en tumores sólidos de mama por lo que valdría la pena explorar esta idea en el caso de infecciones.
CONCLUSIONES
Ante una población cada vez más envejecida como consecuencia del aumento de la expectativa de vida se hace necesario implementar la investigación en aquellos campos que todavía no aportan soluciones para llevar al unísono la reparación integral del cuerpo humano.
AGRADECIMIENTOS
• Al European Research Council a través del proyecto ERC-2015-AdG-694160 (VERDI).
• Al programa de divulgación de ciencia y tecnología ciènciaprop®.
REFERENCIAS
[1] 1-M. Vallet-Regí, A. Ramila, R. P. Del Real and J. PerezPariente, Chem. Mater., 2001, 13, 308–311.
[2] 2- M. Vallet-Regí, F. Balas and D. Arcos, Angew. Chem., Int.
[3] Ed., 2007, 46, 7548–7558
[4] 3-M. Vallet-Regí, Acta Biomater., 2022, 137, 44–52
[5] 4- Marıa Vallet-Regí, Ferdi Schuth, Daniel Lozano, Montserrat Colilla
[6] and Miguel Manzano. Chem. Soc. Rev., 2022,51, 5365
[7] https://youtu.be/IM5e0OEPTo4
[8] https://youtu.be/5FcjSdj2kZk
[9] https://youtu.be/3wgT-dPyHQE
[10] https://youtu.be/_pv-cC3BDSE
[11] https://youtu.be/B4UiQI_x700
[12] https://youtu.be/EfJ6648vJkc
[13] https://youtu.be/g1P-skhgSTc
[14] https://youtu.be/V9lZohqfGTE
[15] https://youtu.be/u3p0ZMgXv0o
AUTORA
 MARÍA VALLET REGÍ nació en Palmas de Gran Canaria en 1946. Es investigadora en el campo de los materiales cerámicos mesoporosos con aplicación en biomedicina, y descubrió las aplicaciones biomédicas potenciales de estos materiales, particularmente en el campo de la regeneración ósea y sistemas de liberación controlada de fármacos. Por sus contribuciones pioneras en este campo ha recibido muchos premios nacionales e internacionales.
MARÍA VALLET REGÍ nació en Palmas de Gran Canaria en 1946. Es investigadora en el campo de los materiales cerámicos mesoporosos con aplicación en biomedicina, y descubrió las aplicaciones biomédicas potenciales de estos materiales, particularmente en el campo de la regeneración ósea y sistemas de liberación controlada de fármacos. Por sus contribuciones pioneras en este campo ha recibido muchos premios nacionales e internacionales.
Dirige el Grupo de Investigación de Biomateriales Inteligentes (GIBI), CIBER-BBN, de la Universidad Complutense de Madrid, donde se encuentra desarrollando diferentes estrategias para curar enfermedades relacionadas con los huesos como el cáncer, la osteoporosis o las infecciones en implantes. En el caso del cáncer, están utilizando nanopartículas de sílice para transportar fármacos en su interior a las zonas dañadas y liberarlas de forma controlada; al detectar las células cancerígenas, las nanopartículas se activan a través de estímulos externos, como ultrasonidos, y liberan el fármaco que mata la célula. Estos métodos selectivos permiten incidir sin dañar las células sanas del entorno. Del mismo modo, las nanopartículas pueden transportar antibióticos para curar infecciones o se pueden fabricar implantes a la carta utilizando impresoras 3D en los que cultivar células madre capaces de regenerar el tejido óseo.
Estudió Química en la Universidad Complutense de Madrid y se doctoro en la misma universidad en 1974. Actualmente, es Catedrática Emérita ERC en la UCM y directora del grupo de investigación GIBI del CIBER-BBN.
Pionera en el campo de los materiales cerámicos mesoporosos con aplicación en biomedicina. Su trabajo descubrió, por vez primera, las aplicaciones biomédicas potenciales de estos materiales, particularmente en el campo de la regeneración ósea y sistemas de liberación controlada de fármacos.
Es autora de más de 800 artículos científicos, 13 patentes y tiene más 60.000 citas y un índice H de 115. María Vallet, es la Primera científica española según PLOS Biology y una de las tres únicas mujeres en el ranking de los 100 investigadores españoles con índice h más alto en cualquier área de conocimiento. Es la primera de la lista del ranking de las 466 investigadoras más importantes, de entre 785 analizadas, residentes en España ordenadas por su índice fh medio (fhm).
Es académica de numero de las Reales Academias Nacional de Farmacia de España (RANFE) y de Ingeniería (RAING) y fellow de FBSE (Fellow Biomaterials Science and Engineering) y de AIMBE (American Institute for Medical and Biological Engineering).